Atomus
Atomus[1] (Graece ἄτομος,[2] "individuus") est minima materiae pars quae elementum constituit, quae in partes minores, proprietates eiusdem elementi habentes, dividi non potest. Atomi diametrum plerumque fere centum picometrorum habent; tam parvae sunt, ut motus eorum, propter effectus quanticos, theoriis physicae classicae non praedici possint.
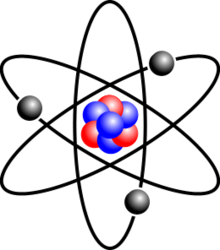


Atomus in denso medio nucleo consistit, nube electronum negative oneratorum cincto. Nucleus atomicus commixtionem continet protonum positive oneratorum et electrice neutra neutrona (excepto casu hydrogenii-1, solum stabilis nuclidi nulla neutrona habentis). Electrona atomi ad nucleum a vi electromagnetica conligantur. Similiter, atomi inter se ligaminibus chemicis ligatae manere possunt, moleculas formantes. Atomus quae aequalem protonum electronumque numerum continet electrice est neutra; aliter, onus vel positivum vel negativum habet, ergo est ion. Atomi in genera describuntur secundum numerum protonum neutronumque in nucleo habitum: numerus protonum elementum chemicum constituit, et numerus neutronum elementi isotopum constituit.[3] Protona et neutrona e quarciis deducuntur.
Atomi secundum numerum protonum in systemate periodico numerantur.
Historia
recensereDemocritus philosophus Graecus erat, qui cogitabat omnem materiam non esse dividuam. Isidorus Hispalensis docebat:
- Atomos philosophi vocant quasdam in mundo corporum partes tam minutissimas ut nec visui pateant nec (tomnu), id est sectionem, recipiant; unde et (atomoi) dictae sunt. Hae per inane totius mundi inrequietis motibus volitare et huc atque illuc ferri dicuntur, sicut tenuissimi pulveres qui infusi per fenestras radiis solis videntur. Ex his arbores et herbas et fruges omnes oriri, ex his ignem et aquam et universa gigni atque constare quidam philosophi gentium putaverunt. . . . Atomus ergo est quod dividi non potest, ut in geometria punctus.
Lucretius de atomis dixit in carmine de Rerum Natura: "semina rerum" (1.59) nominat.
Antonius Laurentius Lavoisier saeculo duodevicensimo elementa chemica definxit. Secundum Lavoisier, elementum est materia quae per rationes chemiae non in alias materies solvi possunt; quod non est elementum est compositum. Nunc scimus composita ex atomis complurium elementorum facta esse; elementa autem ex atomis tantum iisdem. Exempli gratia, aqua, H20, duas atomos hydrogenii et unam atomum oxygenii habet; aqua non est elementum, sed compositum.
Per saeculum undevicensimum, homines chemiae et physicae periti de forma et actionibus atomorum cogitabant. Anno 1869, Demetrius Mendeleev systema periodicum primum edidit, ubi videntur magnitudines et formae atomorum omnium elementorum. Anno 1898, Maria Curie non modo uranium sed alia quoque elementa radioactivitatem habere demonstravit. Anno 1913 Nicolaus Bohr exemplar formae atomorum fecit persimile ei quo iam utimur: descripsit quomodo electrona ambitus circum nucleum faciant.
Plus
recensereSi numerus electronum inaequalis numero protonum sit, non de atomo, sed de ionte dicitur.
Artes chemica et physica sunt scientiae, quae de atomis docent: chemica docet atomos et ionta fingere molecula et alias structuras materiei; physica docet de compositione atomorum et de transmutatione atomorum (fissione vel fusione nucleorum).
Nexus interni
Notae
recensere- ↑ Atomus (-os), -ī, f. Thesaurus Linguae Latinae (1900– ), apud De Gruyter s.v. "atomus".
- ↑ Ἡ ἄτομος (φύσις), feminini generis, vel τὸ ἄτομον (σῶμα), neutri generis. Henricus Liddell, Robertus Scott, A Greek-English Lexicon. 9a ed. (Oxonii, 1925-1940)
- ↑ G. J. Leigh, International Union of Pure and Applied Chemistry, Commission on the Nomenclature of Inorganic Chemistry, Nomenclature of Organic Chemistry: Recommendations 1990 (Oxoniae: Blackwell Scientific Publications, 1990), p. 35: "An atom is the smallest unit quantity of an element that is capable of existence whether alone or in chemical combination with other atoms of the same or other elements."
Bibliographia
recensere- L'Annunziata, Michael F. 2003. Handbook of Radioactivity Analysis. Academic Press. ISBN 0124366031.
- Beyer, H. F., et V. P. Shevelko. 2003. Introduction to the Physics of Highly Charged Ions. CRC Press. ISBN 0750304812.
- Bransden, B. H., et C. J. Joachain. 2003. Physics of Atoms and Molecules. Harlow: Prentice Hall. ISBN 058235692X.
- Choppin, Gregory R., Jan-Olov Liljenzin, et Jan Rydberg. 2001. Radiochemistry and Nuclear Chemistry. Elsevier. ISBN 0750674636.
- Demtröder, Wolfgang. 2002. Atoms, Molecules and Photons: An Introduction to Atomic- Molecular- and Quantum Physics. Springer. ISBN 3540206310.
- Feynman, Richard. 1995. Six Easy Pieces. The Penguin Group. ISBN 0140276661.
- Foot, C. J. 2005. Atomic Physics. Oxonii: Oxford University Press. ISBN 0198506953.
- Fowles, Grant R. 1989. Introduction to Modern Optics. Courier Dover Publications. ISBN 0486659577.
- Gangopadhyaya, Mrinalkanti. 1981. Indian Atomism: History and Sources. Atlantic Highlands Nivae Caesareae: Humanities Press. ISBN 039102177X.
- Goodstein, David L. 2002. States of Matter. Courier Dover Publications. ISBN 048649506X.
- Jevremovic, Tatjana. 2005. Nuclear Principles in Engineering. Springer. ISBN 0387232842.
- Karschenboim, S. G., et V. B. Smirnov, edd. 2003. Precision Physics of Simple Atomic Systems. Berolini: Springer. ISBN 3540404899.
- Kirchhoff, Hans-Werner. 2001. Vorstellungen vom Atom 1800–1934. Aulis Verlag Deubner. ISBN 3761423004.
- Krage, Helge. 2012. Niels Bohr and the Quantum Atom: The Bohr Model of Atomic Structure, 1319-1925. Oxonii: Oxford University Press. ISBN 9780199654987.
- Lequeux, James. 2005. The Interstellar Medium. Springer. ISBN 3540213260.
- Liang, Z.-P., E. M. Haacke, et J. G. Webster, eds. 1999. Encyclopedia of Electrical and Electronics Engineering: Magnetic Resonance Imaging. John Wiley & Sons. ISBN 0471139467.
- Lichtenberg, D. B. 2007. The Atom and the Universe. Singapore: World Scientific. ISBN 9789812706065.
- Mills, Ian, Tomislav Cvitaš, Klaus Homann, Nikola Kallay, et Kozo Kuchitsu. 1993. Quantities, Units and Symbols in Physical Chemistry. Ed. secunda. International Union of Pure and Applied Chemistry, Commission on Physiochemical Symbols Terminology and Units. Oxoniae: Blackwell Scientific Publications. ISBN 0632035838.
- Myers, Richard. 2003. The Basics of Chemistry. Greenwood Press. ISBN 0313316643.
- Padilla, Michael J., Ioannis Miaoulis, et Martha Cyr. 2002. Prentice Hall Science Explorer: Chemical Building Blocks. Prentice-Hall, Inc., Upper Saddle River, Novae Caesareae. ISBN 0130540919.
- Pfeffer, Jeremy I., et Shlomo Nir. 2000. Modern Physics: An Introductory Text. Imperial College Press. ISBN 1860942504.
- Ponomarev, Leonid I. 1993. The Quantum Dice. Ed. 2a. Institute of Physics Pub. ISBN 0750302518.
- Preston, Diana. 2005. Before the Fallout: From Marie Curie to Hiroshima. Novi Eboraci: Walker. ISBN 9780802714459.
- Pullman, Bernard. 1995. L’atome dans l’histoire de la pensée humaine. Lutetiae: Fayard. ISBN 2213594635.
- Shultis, J. Kennth, et Richard E. Faw. 2002. Fundamentals of Nuclear Science and Engineering. CRC Press. ISBN 0824708342.
- Siegfried, Robert. 2002. From Elements to Atoms: A History of Chemical Composition. Transactions of the Americal Philosophical Society, 92, 4. American Philosophical Society. ISBN 0871699249.
- Sills, Alan D. 2003. Earth Science the Easy Way. Barron's Educational Series. ISBN 0764121464.
- Silvestroni, Paolo. 1996. Fondamenti di chimica, editio decima, CEA. ISBN 8840809988.
- Smirnov, Boris M. 2003. Physics of Atoms and Ions. Springer. ISBN 038795550X.
- Teresi, Dick. 2003. Lost Discoveries: The Ancient Roots of Modern Science: From the Babylonians to the Maya. Novi Eboraci: Simon & Schuster. ISBN 074324379X.
- Lide, David R., ed. 2002. Handbook of Chemistry & Physics. Ed. 88a. CRC. ISBN 0849304865.
- Woan, Graham Woan. 2000. The Cambridge Handbook of Physics. Cantabrigiae: Cambridge University Press. ISBN 0521575079.
- Zaider, Marco, et Harald H. Rossi. 2001. Radiation Science for Physicians and Public Health Workers. Springer. ISBN 0306464039.
- Zumdahl, Steven S. 2002. Introductory Chemistry: A Foundation. Ed. 5a. Houghton Mifflin. ISBN 0618343423.
Nexus externi
recensere| Vicimedia Communia plura habent quae ad atomos spectant. |
- Isidorus Hispalensis: De etymologiarum liber XIII De mundo et partibus, Caput II De Atomis
- Archivum Atomicu, www.atomicarchive.com